Мастерская: Простой гальванический элемент.
Всем привет. Представляю вашему вниманию инструкцию по изготовлению гальванического элемента(батарейки) из подручных материалов. Для батарейки нам понадобится: вата, вода, скотч, пластина цинка, пластина олова.

Оловяную и цинковую пластину нужно округлить.

Затем взять вату, намочить и придать форму наших пластин.

Потом все это дело обматывается по контуру скотчем.

На этом изготовление батарейки заканчивается а описание продолжается .
.
Напряжение этого элемента на следующие сутки равно 600 милливольт, самое интересное в том что мы в качестве электролита используем чистую воду. Если использовать кислотные или шелочные электолиты то можно получить и большее напряжение. Емкость батарейки изменяется в площади и толщине прокладок. Полярность у нее будет такая: +олово,-цинк.

Также можно собирать целые батареи этих элементов и паралелить их, приэтом повысив напряжение и емкость.

Плюсами данной батарейки является возможность изготовления практически из всех видов металлов, также батарейка сама себя заряжает под воздействием тепла и времени, можно использовать любые электролиты, простота изготовления, возможность хранить в холодильнике с последующим размораживанием и восстановлением свойств, можно заряжать малым током и не боятся взрыва, если батарейка высохла то ее можно намочить и она как новая.
Минусами являются малая емкость батареи, способность ухудшать свои качества на морозе, габариты, пластины со временем разрушаются.

Оловяную и цинковую пластину нужно округлить.

Затем взять вату, намочить и придать форму наших пластин.

Потом все это дело обматывается по контуру скотчем.

На этом изготовление батарейки заканчивается а описание продолжается
 .
.Напряжение этого элемента на следующие сутки равно 600 милливольт, самое интересное в том что мы в качестве электролита используем чистую воду. Если использовать кислотные или шелочные электолиты то можно получить и большее напряжение. Емкость батарейки изменяется в площади и толщине прокладок. Полярность у нее будет такая: +олово,-цинк.

Также можно собирать целые батареи этих элементов и паралелить их, приэтом повысив напряжение и емкость.

Плюсами данной батарейки является возможность изготовления практически из всех видов металлов, также батарейка сама себя заряжает под воздействием тепла и времени, можно использовать любые электролиты, простота изготовления, возможность хранить в холодильнике с последующим размораживанием и восстановлением свойств, можно заряжать малым током и не боятся взрыва, если батарейка высохла то ее можно намочить и она как новая.
Минусами являются малая емкость батареи, способность ухудшать свои качества на морозе, габариты, пластины со временем разрушаются.
Похожие записи
- альтернативные источники электричества 39
- Мини БП на рабочем месте. 39
- Электричество до БП, вовремя БП и после БП. (Часть 3-я . Электричество после БП) 221
- Электричество в вашем доме. Зло или благо ? Зависит от вас... 152
- Электричество до БП, вовремя БП и после БП. (Часть 2-я . Электричество во время БП) 50
09 июня 2013, 12:57
+365.11 botsman
— Смоленщина
Вы в лесу, или ещё … знает где. Осталось только найти «пластинку цинка» и «пластинку олова» и у вас будет электричество!

- v
- 0
09 июня 2013, 13:00
+43.01 Stalker1998
— Усть-Каменогорск
Я использовал оцинковку, а олово можно найти в любом электронном устройстве.
- v
- 0
09 июня 2013, 13:14
+1.32 Kyrykun
— Астрахань
Если уж Вы помянули «разные металлы», можно было бы приложить что-то такое 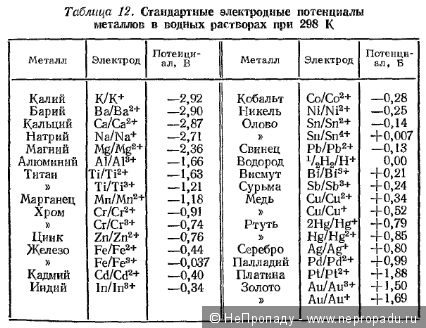 и разъяснитьYour text to link....
и разъяснитьYour text to link....
 и разъяснитьYour text to link....
и разъяснитьYour text to link....
09 июня 2013, 14:47
Чистое олово вряд ли вы найдете в бытовом устройстве. Припои обычно оловянно-свинцовые, с содержанием пополам (отечественный ПОС-61 содержит 61% олова). Хотя тенденции таковы, что многие переходят на безсвинцовые припои, содержание олова в которых высоко (около 90%).
P.S. Хотя с точки зрения электроотрицательности выходит одно и тоже, если судить по таблице выше.
P.S. Хотя с точки зрения электроотрицательности выходит одно и тоже, если судить по таблице выше.

09 июня 2013, 14:08
+17.52 belowolk
— Киев
Стаття в це лом полезна, но исклбчителтно в теории, так как такие элементы дают очень слабое напряжение.
- v
- 0
12 июня 2013, 19:48
+31.10 SvartUlv
— из Сибири
Был у нас заводик в советские времена. Чуть ли не единственный в Союзе. Теперь на его месте-свалка


- v
- 0
15 июня 2013, 15:35
Новые знания! Для не-физика, -химика, -математика- типа меня, это уже прогресс!!! Плюсанул бы но живучести мало! Ну хоть здесь + )))
- v
- 0
19 июня 2013, 19:11
+0.20 WeiBRabe
— Пенза
в банку налить электролит, в крышку воткнуть большой гвоздь и толстый оловянный припой, вот вам и нормальная ёмкость можно зажечь пару лампочек(1.5вольт)
- v
- 0
23 июня 2013, 08:05
+43.01 Stalker1998
— Усть-Каменогорск
Можно ваще открыть верх конденсатора и залить туда какой-нибуть электролит
- v
- 0
23 июня 2013, 09:50
Ну вы блин даёте… эти перлы в юмор надо…
Только Kyrykun дал подсказку…
Для понимания процесса, надо знать Электрохимический ряд активности металлов,
Чем дальше друг от друга находятся в ряду металлы гальванической пары, тем эффективнее будет батарея…
Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→Mn→Zn→Cr→Fe→Cd→Co→Ni→Sn→Pb→H→Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au
ru.wikipedia.org/wiki/Электрохимический_ряд_активности_металлов
Плюсами данной батарейки является возможность изготовления практически из всех видов металлов, также батарейка сама себя заряжает под воздействием тепла и времени, можно использовать любые электролиты, простота изготовления, возможность хранить в холодильнике с последующим размораживанием и восстановлением свойств, можно заряжать малым током и не боятся взрыва, если батарейка высохла то ее можно намочить и она как новая.В век цифровых технологий не хватает тяму изучить теорию школьного курса физики…
Минусами являются малая емкость батареи, способность ухудшать свои качества на морозе, габариты, пластины со временем разрушаются.
Только Kyrykun дал подсказку…
Для понимания процесса, надо знать Электрохимический ряд активности металлов,
Чем дальше друг от друга находятся в ряду металлы гальванической пары, тем эффективнее будет батарея…
Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→Mn→Zn→Cr→Fe→Cd→Co→Ni→Sn→Pb→H→Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au
ru.wikipedia.org/wiki/Электрохимический_ряд_активности_металлов
- v
- 0



Комментарии (13)